初中化学人教版9年级上下全册知识点 - 第三单元 物质构成的奥秘
初中化学人教版9年级上下全册知识点 - 第三单元 物质构成的奥秘
第三单元 物质构成的奥秘
课题1 分子和原子
1、构成物质的粒子有:原子、分子、离子。
2、铁是由铁原子构成,水由水分子构成,氯化钠由氯离子和钠离子构成。
一、分子
1、分子的定义:由分子构成的物质,分子是保持物质化学性质的最小粒子。
2、分子的基本性质:
① 质量和体积都很小;
② 分子在不停的运动;注意:温度越高,运动越快。
③ 分子间有间隔;气体分子间间隔较大,液体、固体分子间间隔较小。
3、分子的构成:分子由原子构成。如:1个水分子由两个氢原子和一个氧原子构成。
4、由分子构成的物质,其化学式也叫分子式。
二、原子:化学变化中的最小粒子。
原子的基本性质:原子的质量、体积都很小;在不断运动的;原子间有间隔
三、分子和原子的区别与联系。
区别:化学变化中,分子要分成原子,而原子却不能再分。
联系:分子由原子构成,分子和原子都可直接构成物质。
四、分子、原子观点的运用
1 从微观角度分析物质的变化
物理变化时,分子原子本身大小不变,只是分子间的间隔大小发生变化。
化学变化时,分子要分解成原子,原子重新组合成新的分子。
2各类物质的微观构成:
混合物由多种分子构成; 纯净物由一种分子构成。
单质由一种原子构成的同种分子构成;化合物由多种原子构成的同种分子构成
课题2原子的构成
一、原子的构成
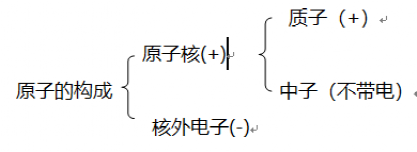
1、构成物质的三粒子:原子、分子、离子。
构成原子的三种粒子:质子、中子、电子。
原子由原子核和核外电子两部分构成。
2、原子不显电性的原因:原子核带的正电荷数与核外电子所带电量相等,电性相反。
3、原子的质量主要集中原子核;原子的质量主要由质子和中子决定。
4、不是所有原子都含有中子,如氢原子就不含中子。
5、原子中的等量关系:核电荷数=质子数=电子数。
二、原子核外电子的排布
1、核外电子是分层排布的。
2、核外电子排布的规律:
第一层最多2个。第二层最多8个。最外层不超过8个(只有一层不超过2个)
3、1-20号元素的原子结构示意图。
4、元素在周期表中的周期数等于原子的电子层数。
5、元素的化学性质主要取决于原子的最外层电子数。
注:(1) 稳定结构:最外层具有8个电子(只有一层具有2个电子)的结构。
(2) 各类元素性质与原子结构的关系:
最外层电子数 | 得得失电子倾向 | 化学性质 | |
金属元素 | 一般少于4个 | 易失 | 不稳定 |
非金属元素 | 一般为4-7个 | 易得 | 不稳定 |
稀有气体元素 | 8个(He为2个) | 不易得失 | 稳定 |
三、离子
1、离子:带电荷的原子或原子团。
2、离子的分类
阳离子;带正电荷的离子。如:H+、Na+、Mg2+、Al3+、Ca2+、NH4+、Fe3+、Fe2+
阴离子:带负电荷的离子。O2-、S2-、Cl-、OH-、SO42-、CO32-、NO3-、PO43-
3、离子符号的意义:Mg2+:表示镁离子.1个镁离子带2个单位的正电荷
2Mg2+:表示2个镁离子.
4、离子的判断:质子数>电子数的是阳离子。 质子数<电子数的是阴离子。
5、离子与形成离子的原子在质量上相等,且属于同种元素。
四、相对原子质量
1 概念:以一种碳原子质量的1/12为标准,其它原子的质量跟它相比较所得的比,就是相对原子质量。
2 计算式:相对原子质量= 
3 相对原子质量=质子数+中子数。 注意:相对原子质量不是实际质量,单位是1,省略。
课题3 元素
一 、元素
1 元素:质子数(即核电荷数)相同的一类原子的总称。
2 元素的种类由质子数决定;不同元素的本质区别:质子数(或核电荷数)不同。
3 元素分成三类:金属元素、非金属元素、稀有气体元素。
4 地壳中的元素,按质量分数计算,居前四位的是:O>Si>Al>Fe。
■地壳中含量最多的元素是O ;最多的非金属元素是O ;最多的固态非金属元素Si ;最多的金属元素是Al 。
注意:(1)元素与原子的区别:元素组成物质,元素只讲种类,不讲个数。
原子构成分子,原子既讲种类,也讲个数。
如:水由氢元素和氧元素组成; 水由水分子构成。
水分子由氢原子和氧原子构成;1个水分子由两个氢原子和1个氧原子构成
(2)化学反应前后:分子种类一定变,分子数目不一定变。
原子种类和数目一定不变。元素种类和质量一定不变。
二、元素符号的意义
1、一种元素
2、一个原子。
3、除N、H、O、F、Cl、Br、I外的元素符号还表示单质.
三、元素符号的书写规则:一大二小.
四、元素周期表:
1、俄国化学家门捷列夫发现了元素周期律并编写了元素周期表。
2、元素周期表的结构:7个横行7个周期;18个纵行16个族。
除第一周期外,每一周期以金属元素开头,稀有气体元素结尾。
每一单元格包含原子序数、元素符号、元素名称、相对原子质量等信息。
3、原子序数==核电荷数==质子数。
4、下列符号的意义。
H:表示氢元素、1个氢原子。 2H:表示2个氢原子。
S:表示硫元素、1个硫原子、硫单质。 2S:表示2个硫原子。
扫描二维码推送至手机访问。
特别声明:
本站属于公益性网站,纯粹个人原因(陪孩子学习便于查询和教授),网站部分内容收集于网络,仅供学生和老师参考、交流使用,请勿用作其他商业收费用途。
如果网站内容能给你带来提升,那便是我经营此网站的初衷。网站相关内容如有问题,请及时提出,我在此谢谢!
本站尊重原创并对原创者的文章表示肯定和感谢,如有侵权请联系删除!针对本站原创内容,本站也欢迎转载,如需转载请注明出处。