初中化学人教版9年级上下全册知识点 - 初中化学方程式汇总
初中化学人教版9年级上下全册知识点 - 初中化学方程式汇总
初中化学方程式汇总
一、 氧气的性质:
■单质与氧气的反应:
镁在空气中燃烧:2Mg + O2 2MgO
2MgO
铁在氧气中燃烧:3Fe + 2O2 Fe3O4 (注意生成物不是Fe2O3)
Fe3O4 (注意生成物不是Fe2O3)
铜在空气中受热:2Cu + O2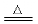 2CuO
2CuO
铝在空气中燃烧:4Al + 3O2  2Al2O3 (注意不要将Al2O3写成AlO)
2Al2O3 (注意不要将Al2O3写成AlO)
氢气中空气中燃烧:2H2 + O2 2H2O
2H2O
红磷在空气中燃烧(研究空气组成的实验):4P + 5O2 2P2O5
2P2O5
硫粉在空气中燃烧:S + O2 SO2
SO2
碳在氧气中充分燃烧:C + O2 CO2
CO2
碳在氧气中不充分燃烧:2C + O2 2CO
2CO
■化合物与O2的反应:
一氧化碳在氧气中燃烧:2CO + O2 2CO2
2CO2
甲烷在空气中燃烧:CH4 + 2O2 CO2 + 2H2O
CO2 + 2H2O
酒精在空气中燃烧:C2H5OH + 3O2 2CO2 + 3H2O
2CO2 + 3H2O
■O2的来源:
玻义耳研究空气的成分实验 2HgO Hg+ O2 ↑
Hg+ O2 ↑
原理1加热高锰酸钾:2KMnO4 K2MnO4 + MnO2 + O2↑
K2MnO4 + MnO2 + O2↑
原理2氯酸钾制取氧气:2KClO3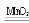 2KCl+3O2↑
2KCl+3O2↑
原理3过氧化氢在二氧化锰作催化剂条件下分解反应:2H2O2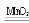 2H2O+O2 ↑
2H2O+O2 ↑
二、自然界中的水:
水在直流电的作用下分解(研究水的组成实验):2H2O 2H2↑+ O2 ↑
2H2↑+ O2 ↑
生石灰溶于水:CaO + H2O == Ca(OH)2
二氧化碳可溶于水:H2O + CO2==H2CO3
三、质量守恒定律:
镁在空气中燃烧:2Mg + O2 2MgO
2MgO
铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu
氢气还原氧化铜:H2 + CuO  Cu + H2O
Cu + H2O
四、碳和碳的氧化物:
■碳的化学性质
碳在氧气中充分燃烧:C + O2 CO2
CO2
木炭还原氧化铜:C+ 2CuO  2Cu + CO2↑
2Cu + CO2↑
焦炭还原氧化铁:3C+ 2Fe2O3 4Fe + 3CO2↑
4Fe + 3CO2↑
■煤炉中发生的三个反应:(几个化合反应)
底层:C + O2 CO2
CO2
煤炉的中层:CO2 + C  2CO
2CO
煤炉的上部蓝色火焰的产生:2CO + O2 2CO2
2CO2
■二氧化碳的制法与性质:
大理石与稀盐酸反应(实验室制二氧化碳):CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
碳酸不稳定而分解:H2CO3 == H2O + CO2↑
二氧化碳可溶于水:H2O + CO2== H2CO3
高温煅烧石灰石(工业制二氧化碳):CaCO3 CaO + CO2↑
CaO + CO2↑
石灰水与二氧化碳反应(鉴别二氧化碳):Ca(OH)2 + CO2 == CaCO3 ↓+ H2O
■一氧化碳的性质:
一氧化碳还原氧化铜:CO+ CuO  Cu + CO2 (注意条件不是高温)
Cu + CO2 (注意条件不是高温)
一氧化碳的可燃性:2CO + O2 2CO2
2CO2
■其它反应:
碳酸钠与稀盐酸反应(灭火器的原理):
Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑ (注意不要将Na2CO3写成NaCO3)
五、燃料及其利用:
甲烷在空气中燃烧:CH4 + 2O2 CO2 + 2H2O
CO2 + 2H2O
酒精在空气中燃烧:C2H5OH + 3O2 2CO2 + 3H2O
2CO2 + 3H2O
氢气中空气中燃烧:2H2 + O2 2H2O
2H2O
六、金属
■金属与O2反应:
镁在空气中燃烧:2Mg + O2 2MgO(注意不要将MgO写成MgO2)
2MgO(注意不要将MgO写成MgO2)
铁在氧气中燃烧:3Fe + 2O2 Fe3O4(注意不要将Fe3O4写成Fe2O3)
Fe3O4(注意不要将Fe3O4写成Fe2O3)
铜在空气中受热:2Cu + O2 2CuO
2CuO
铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3
■金属单质 + 酸 -------- 盐 + H2↑ (置换反应)
锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑
铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑
镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑
铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑
锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑
铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑(注意不要将FeCl2写成FeCl3)
镁和稀盐酸Mg+ 2HCl == MgCl2 + H2↑
铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑
■金属单质 + 盐(溶液) ------- 新金属 + 新盐
铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu
锌和硫酸铜溶液反应:Zn + CuSO4 ==ZnSO4 + Cu
铜和硝酸汞溶液反应:Cu + Hg(NO3)2 == Cu(NO3)2 + Hg
■金属铁的治炼原理:3CO+ Fe2O3 2Fe + 3CO2
2Fe + 3CO2
七、酸、碱、盐
1、酸的化学性质
■酸 + 金属 → 盐 + 氢气(见上)
■酸 + 金属氧化物→ 盐 + 水
稀盐酸除铁锈的反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O
稀硫酸除铁锈的反应:Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O
氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O
氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O
■酸 + 碱→盐 + 水(中和反应)
盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O
盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2O
氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O
硫酸和烧碱反应:H2SO4 + 2NaOH == Na2SO4 + 2H2O
■酸 + 盐 →新酸 + 新盐
大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑
硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl
2、碱的化学性质
■ 碱 + 非金属氧化物 → 盐 + 水
苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O
苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O
苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O
消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3 ↓+ H2O
消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3 ↓+ H2O
■碱 + 酸→ 盐 + 水(中和反应,方程式酸+碱的反应)
■碱 + 盐 → 另一种碱 + 另一种盐
氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH
3、盐的化学性质
■盐(溶液)+ 金属单质→新金属 + 新盐
铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu
■盐 + 酸→新酸 + 新盐
碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑
■盐 + 碱 →新碱 + 新盐
氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH
■盐 + 盐 → 两种新盐
氯化钠溶液和硝酸银溶液:NaCl + AgNO3 == AgCl↓ + NaNO3
硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl
注意:碱与盐、盐与盐的反应,生成物要有H2O、↓、↑且反应物必须可溶于水。
扫描二维码推送至手机访问。
特别声明:
本站属于公益性网站,纯粹个人原因(陪孩子学习便于查询和教授),网站部分内容收集于网络,仅供学生和老师参考、交流使用,请勿用作其他商业收费用途。
如果网站内容能给你带来提升,那便是我经营此网站的初衷。网站相关内容如有问题,请及时提出,我在此谢谢!
本站尊重原创并对原创者的文章表示肯定和感谢,如有侵权请联系删除!针对本站原创内容,本站也欢迎转载,如需转载请注明出处。