初中化学人教版9年级上下全册知识点 - 第六单元 碳和碳的化合物
初中化学人教版9年级上下全册知识点 - 第六单元 碳和碳的化合物
第六单元 碳和碳的化合物
课题1 金刚石、石墨、C60
一、碳的单质
1、金刚石:物理性质:透明、最硬、不导电。
用途:钻头、刻刀、钻石。
2、石墨:物理性质:深灰色、不透明、很软、能导电、有润滑性。
用途:作铅笔芯、电极、润滑剂。
注意:含石墨晶体的还有木炭、焦炭、活性炭、炭黑,均为混合物。
3、C60 由C60分子构成,很稳定,应用于材料科学,超导体。
4、注意:
a:碳元素组成的单质有金刚石、石墨、C60 ,其中金刚石、石墨是由碳原子构成的。C60是由分子构成的。
b: 金刚石、石墨、C60的化学性质相同;物理性质不同,物理性质不同的原因是由于碳原子的排列方式不同。
c:木炭与活性炭有吸附性,可吸附色素、毒气、异味。
d:石墨金刚石。该变化属于化学变化。
二、碳的化学性质
1、常温下很稳定。稳定性属于化学性质。
2、可燃性:C + O2 CO2(氧气充足)
CO2(氧气充足)
2C + O2 2CO(氧气不足)
2CO(氧气不足)
3、还原性:3C + 2Fe2O3 4Fe + 3CO2↑
4Fe + 3CO2↑
C + CO2 2CO (该反应吸热)
2CO (该反应吸热)
C + 2CuO 2Cu + CO2↑
2Cu + CO2↑
◆木炭还原氧化铜实验
①现象:黑色粉末变为红色,石灰水变浑浊。
②实验结束时,要先将导管移出水面,再停止加热,以防止石灰水倒流,引起试管炸裂。
③同时要防止空气进入将生成的铜氧化。
4、(1)氧化反应:物质与氧发生的反应叫氧化反应。
还原反应:含氧化合物中的氧被夺去的反应叫还原反应。
(2)反应中夺取氧的物质具有还原性,是还原剂,发生氧化反应。
反应中失氧的物质具有氧化性,是氧化剂,发生还原反应。
(3)常见还原剂:木炭、一氧化碳、氢气
三、碳的用途:作燃料、冶炼金属。
课题2 二氧化碳制取的研究
一、CO2的实验室制法
1、药品:大理石或石灰石、稀盐酸。
2、原理:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑(复分解反应)
3、发生装置要点:长颈漏斗下端管口要伸入液面下;导气管伸出橡皮塞少许。
收集装置要点:只能用向上排空气法收集。
◆排空气法收集气体时导管末端要伸入集气瓶底部。
◆不能用排水法收集的原因是因CO2能溶于水且能与水反应。
4、步骤:
(1) 连接装置,检查气密性;
教材P115图6-12发生装置气密性的检查方法:用弹簧夹夹住橡皮管,往长颈漏斗中加水;若长颈漏斗中形成水柱,且保持液面不下降,则不漏气。
(2) 装入药品,先加固体,再加液体。
(3) 收集气体.
5、检验CO2的存在:将气体通人澄清石灰水,若变浑浊,则证明是CO2。
检验CO2是否收集满:将燃着的木条放在集气瓶口,若熄灭,则集满。
注意:
(1)制取CO2不用浓盐酸,因为浓盐酸有很强的挥发性,挥发出的HCl会使制的CO2不纯。
(2)制取CO2不用硫酸,因为生成的CaSO4微溶于水,覆盖在CaCO3表面,阻止反应继续进行。
(3)制取CO2不用Na2CO3,因为反应太剧烈,不易控制。
(4)Ca(OH)2的名称:化学名称:氢氧化钙。俗名: 熟石灰、消石灰
Ca(OH)2的水溶液叫石灰水。
(5) 实验室制取气体的发生装置由反应物的状态和反应条件决定。
①固体与固体加热则与氯酸钾制氧的发生装置相同。
②固体与液体不加热则与过氧化氢制氧的发生装置相同。
二、CO2的工业制法:CaCO3 CaO + CO2↑(分解反应)
CaO + CO2↑(分解反应)
注意:CaO的俗名:生石灰。CaO能与H2O反应,且放出大量的热。
反应方程式为:CaO + H2O == Ca(OH)2
三、CO32-的检验:
试剂:稀盐酸、澄清石灰水。
现象:取被检验的物质加入盐酸,若有气泡产生,该气体能使澄清石灰石变浑浊,则证明含有CO32-离子。
课题3 二氧碳和一氧化碳
一、二氧化碳
1、物理性质:无色、无味、密度比空气大、能溶于水、干冰能升华。
2、化学性质
(1)一般情况下,不能燃烧,不能支持燃烧。
(2) CO2 + H2O == H2CO3 (CO2使石蕊试液变红的反应)
H2CO3 ==CO2↑+ H2O(加热上述变红的溶液,溶液由红变紫的反应)
(3) CO2 + Ca(OH)2== CaCO3 ↓+ H2O (CO2使石灰水变浑浊的反应)
CO2 + 2NaOH == Na2CO3+ H2O (用NaOH溶液吸收CO2的反应)
(4) C + CO2 2CO (CO2转化为CO的反应、吸热)
2CO (CO2转化为CO的反应、吸热)
3、CO2的用途:①干冰可作制冷剂和人工降雨剂。②灭火。
③气体肥料。④植物光合作用的原料。⑤化工原料。
4、温室效应:
造成温室效应的气体:CO2 、O3、CH4、 氟氯代烷等。
防止措施:①用清洁能源代替化石燃料;②植树造林,禁止乱砍滥伐。
5、注意:CO2灭火的原因:①不能燃烧、②不能支持燃烧、③密度比空气大。
二、一氧化碳
1、物理性质:无色、无味、难溶于水、密度比空气略小。
注意:CO只能用排水法收集,不能用排空气法收集。
2、化学性质:
(1)可燃性:CO + O2 2CO2(蓝色火焰)
2CO2(蓝色火焰)
(2)毒性。煤气中毒的原因:一氧化碳与人体中的血红蛋白结合,使血红蛋白不能很好地与氧气结合,造成人体缺氧。
注意:
①冬天用煤火取暖时,一定要装烟囱,并且注意通风。
②家用煤气(含一氧化碳)发生泄漏时,应该立即关闭阀门、开窗通风;一定不能点火、开灯、打电话。
(3)还原性:CO+ CuO 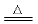 Cu + CO2(该反应可用于除去CO2中CO )
Cu + CO2(该反应可用于除去CO2中CO )
注意:
①该实验开始时,要先通CO再加热,以防爆炸。
②该实验结束时,要先停止加热,试管冷却后,再停止通CO,以防生成的铜被空气氧化。
③ 尾气中CO的必须处理,防止污染空气处理方法:点燃或用气球收集。
3、用途:①作燃料。 ②冶炼金属。
4、注意:
(1)除去CO2中的CO的方法:将混合气体通过灼热的CuO。
(化学反应方程式:CO+ CuO Cu + CO2)
Cu + CO2)
(2)除去CO中的CO2的方法:将混合气体通过澄清石灰水或NaOH溶液。
(化学反应方程式:CO2 + Ca(OH)2 = CaCO3 ↓+ H2O)
(3)除去混合气体中的 O2的方法:将混合气体通过灼热的Cu网。
(化学反应方程式:O2+ 2Cu 2CuO)
2CuO)
(4)具有还原性的物质有:H2、CO 、 C 。
扫描二维码推送至手机访问。
特别声明:
本站属于公益性网站,纯粹个人原因(陪孩子学习便于查询和教授),网站部分内容收集于网络,仅供学生和老师参考、交流使用,请勿用作其他商业收费用途。
如果网站内容能给你带来提升,那便是我经营此网站的初衷。网站相关内容如有问题,请及时提出,我在此谢谢!
本站尊重原创并对原创者的文章表示肯定和感谢,如有侵权请联系删除!针对本站原创内容,本站也欢迎转载,如需转载请注明出处。